

第1页 / 共14页

第2页 / 共14页

第3页 / 共14页
第4页 / 共14页

第5页 / 共14页
第6页 / 共14页

第7页 / 共14页
试读已结束,还剩7页,您可下载完整版后进行离线阅读
高中化学选修知识点总结此内容为付费资源,请付费后查看
黄金会员免费钻石会员免费
付费资源
© 版权声明
文章版权归作者所有,未经允许请勿转载。
THE END
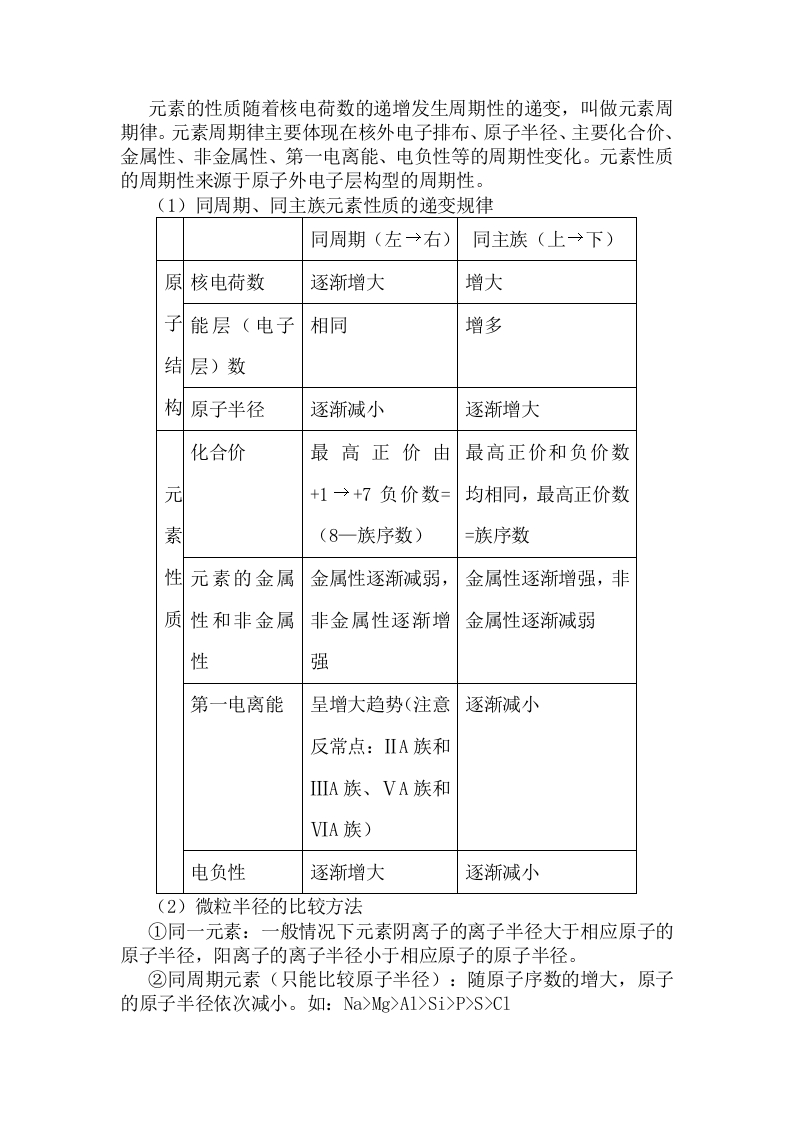
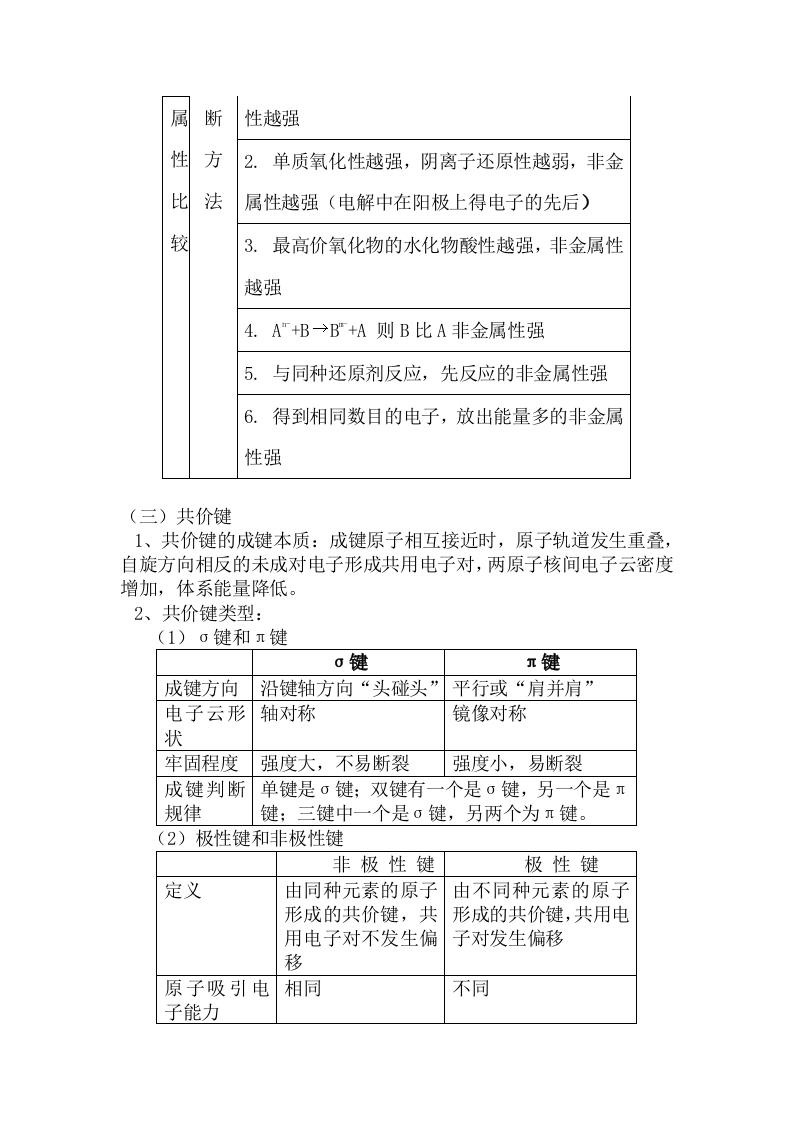
高中化学选修3知识点总结二、复习要点1、原子结构2、元素周期表和元素周期律3、共价键4、分子的空间构型5、分子的性质6、晶体的结构和性质(一)原子结构1、能层和能级(1)能层和能级的划分能层能级1Is2L283I3s3p3d4N4s4p4d4fO5p5d6P6s6P6dQ7s7P7d原子轨道:1357可容纳电子数:261014①在同一个原子中,离核越近能层能量越低。②同一个能层的电子,能量也可能不同,还可以把它们分成能级s、p、d、f,能量由低到高依次为s、p、d、f。③任一能层,能级数等于能层序数。④s、p、d、f…可容纳的电子数依次是1、3、5、7…的两倍。⑤能层不同能级相同,所容纳的最多电子数相同。(2)能层、能级、原子轨道之间的关系能层n123林号KLMN能绿P轨道数13357最多容纳262610261014的电子数2818322n2每能层所容纳的最多电子数是:2n2(n:能层的序数)。2、构造原理w@●●○@⊙⑧@⊙o@@⊙D⊙DO。®(1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。(2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。(3)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。原子轨道的能量关系是:ns<(n-2)f<(n-1)d Mg>A1>Si>P>S>C1















暂无评论内容